Общая химия
Содержание:
- Содержание:
- Моль — единица химического количества вещества
- Растворы. Способы выражения концентрации
- В чём разница между EC- и TDS-метрами?
- Формула молярной концентрации, единица измерения
- Ценность исследования
- 1.1.1 Количество вещества — моль вещества
- Качественное описание
- Расшифровка
- Eau (eu) de parfum: что это такое значит
- Eau de toilette
- Почему EC практичнее, чем TDS/ppm?
- Массовая доля в химии — что это за параметр
Содержание:
В молярность — концентрация раствора, выраженная в молях растворенного вещества на литр раствора. Он обозначается аббревиатурой M и выражает отношение между массой растворенного вещества и объемом раствора (м / об); хотя традиционно это соотношение выражается как вес к объему.
Моль — это количество атомов или молекул, содержащихся в атомной или молекулярной массе; Выражается в граммах / моль. Один моль равен 6,02 · 1023 атомы или молекулы, известные как число Авогадро.
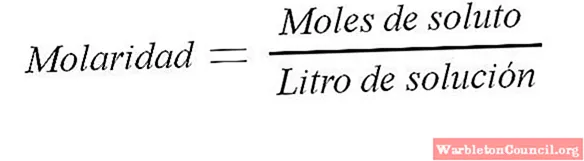
Есть и другие способы выразить взаимосвязь между массой растворенного вещества и объемом, в том числе: процентное соотношение между массой растворенного вещества и объемом раствора и нормальность. Последнее выражается как количество эквивалентов растворенного вещества на литр раствора.
Между тем, моляльность, которая определяется как количество молей на килограмм растворителя, обычно воды, выражает соотношение между массой растворенного вещества и массой растворителя (м / м).
Форма выражения концентрации раствора в частях на миллион (ppm) выражает отношение между одной частью растворенного вещества и одним миллионом частей раствора, обычно используется для выражения отношения массы к массе (м / м). Но вы можете выразить отношение массы к объему (m / v).
Молярная концентрация может быть выражена не только в молях на литр, но и в миллимолях на литр (миллимолярный раствор); микромоль / литр (микромоль раствор); и т.п.
Проблемы молярности могут быть решены с помощью аналитического метода и «правила трех». Выбор метода будет зависеть от навыков, которыми вы обладаете при использовании одного из методов.
Моль — единица химического количества вещества
Каждая из основных физических величин имеет свою единицу. Например, единица длины — метр (м), массы — килограмм (кг), времени — секунда (с). Единицей химического количества вещества является моль.
Моль — порция вещества (т. е. такое его химическое количество), которая содержит столько же структурных единиц, сколько атомов содержится в углероде массой 0,012 кг.
Сокращенное обозначение единицы химического количества записывается, как и полное, — моль. Поэтому, если слово «моль» стоит после числа, то оно не склоняется, так же, как и другие сокращенные единицы величин: 3 кг, 5 л, 8 моль. При чтении вслух и при записи числительного буквами слово «моль» склоняется: три килограмма, пять литров, восемь молей.
На заметку. Термины «молекула» и «моль», как нетрудно заметить, однокоренные. Они действительно произошли от одного и того же латинского слова «moles». Но это слово имеет, по крайней мере, два значения. Первое — «маленькая масса». Именно в этом смысле в XVII в. оно превратилось в термин «молекула». А понятие «моль» (в смысле кучка, порция) появилось значительно позже, в начале ХХ в. Автор этого термина известный немецкий химик и физик Оствальд толковал его смысл как «большая масса», как бы противопоставляя термину «молекула».
Число (N) атомов в порции углерода массой 0,012 кг легко определить, зная массу одного атома углерода (19,94·10-27 кг):
Следовательно, в углероде массой 0,012 кг содержатся 6,02·1023 атомов углерода и эта порция составляет 1 моль. Столько же структурных единиц содержится в 1 моль любого вещества.
Величина, равная:
получила название постоянной Авогадро. Она является одной из важнейших универсальных постоянных и обозначается символом NA:
Единица в числителе дроби (1/моль) заменяет название структурной единицы.
Если структурной единицей вещества (например, меди, углерода) является атом, то в порции этого вещества количеством 1 моль содержатся 6,02·1023атомов. В случае веществ молекулярного строения (вода, углекислый газ) их порции количеством 1 моль содержат по 6,02·1023молекул. Если структурными единицами веществ немолекулярного строения (например, NaCl или CuSO4) являются их формульные единицы, то в порциях этих веществ количеством 1 моль содержатся по 6,02·1023формульных единиц.
На заметку. Численное значение постоянной Авогадро огромно. О том, насколько велико это число, можно судить по следующему сравнению. Поверхность Земли, включая и водную, равна 510 000 000 км2. Если равномерно рассыпать по всей этой поверхности 6,02·1023 песчинок диаметром 1 мм, то они образуют слой песка толщиной более 1 м.
Зная химическое количество n данного вещества Х, легко рассчитать число молекул (атомов, формульных единиц) N(Х) в этой порции:
если 1 моль вещества содержит 6,02·1023 молекул, то n моль вещества содержат N(Х) молекул.
Отсюда:
И наоборот, по числу структурных единиц можно рассчитать химическое количество вещества:
Пример 1. Определите число молекул, содержащихся в серной кислоте химическим количеством 3 моль.
Спойлер
Пример 2. Рассчитайте химическое количество CuSO4 в порции, содержащей 36,12·1023 формульных единиц (ФЕ).
Спойлер
Краткие выводы урока:
- Химическое количество вещества — физическая величина, пропорциональная числу структурных единиц, содержащихся в данной порции вещества.
- Моль — единица химического количества вещества, т. е. такое его количество, которое содержит 6,02·1023 структурных единиц.
Надеюсь урок 8 «Химическое количество вещества и моль» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Растворы. Способы выражения концентрации
Истинными
растворами называются гомогенные системы, состоящие из двух или
большего числа компонентов, состав которых может непрерывно
меняться в определенных пределах.
Агрегатное состояние растворов может быть твердым, жидким или
газообразным. Обычно термин “растворы” относят к жидким
системам. Компонент раствора, имеющий то же агрегатное
состояние, что и раствор, называют растворителем, остальные
компоненты – растворенными веществами. Это деление достаточно
условно, например в растворе, компонентами которого являются
азотная кислота и вода, растворителем и растворенным веществом
можно считать каждый из компонентов. Подобные растворы называют
взаимными, например взаимный раствор азотной кислоты и воды.
Однако в случае, когда одним из компонентов раствора является
вода, ее традиционно считают растворителем.
Содержание растворенного вещества в растворе
может быть выражено несколькими способами:
Массовая доля растворенного вещества:
отношение массы растворенного вещества к массе раствора:
где – массовая доля
растворенного вещества, – масса
растворенного вещества, – масса
раствора. Это частный случай определения массовой доли.
Концентрация (молярная концентрация,
молярность): отношение количества растворенного вещества
к объему раствора V:
Молярная концентрация имеет принятую в химии размерность
[моль/л], которая часто обозначается М и называется молярностью.
Например, концентрация раствора 5 моль/л может быть записана как
5 М и такой раствор называется пятимолярным.
Эквивалентная (нормальная)
концентрация: отношение количества эквивалентов
растворенного вещества ЭКВ к
объему V раствора:
Эквивалент – это реальная или
условная частица вещества, которая в данной кислотно-основной
реакции эквивалента (равна) одному иону водорода или в данной
окислительно-восстановительной реакции – одному электрону.
Например в реакции
H2SO4 = K2SO4 +
2H2O
эквивалентом
гидроксида калия будет молекула КОН, а серной кислоты молекулы H2SO4.
Фактор эквивалентности
fЭКВ показывает, какая доля реальной частицы
данного вещества в данной кислотно-основной реакции эквивалента
(равна) одному иону водорода или в данной
окислительно-восстановительной реакции – одному электрону.
Для приведенного примера
1
1/2
Величина, обратная фактору
эквивалентности, называется эквивалентным числом
zB:
Число частиц эквивалентов вещества
NЭ связано с числом реальных частиц N
соотношением:
Количество вещества эквивалента
равно отношению числа частиц эквивалентов к числу Авогадро:
Молярная масса эквивалента равна отношению массы вещества к
количеству вещества эквивалента:
и имеет
размерность г/моль.
Эквивалентная
концентрация имеет размерность [моль эквивалента/л] и называется
также нормальной концентрацией или нормальностью раствора и
обозначается н. Например, раствор с эквивалентной
концентрацией 0,5 моль-эквивалентов/л называется полунормальным,
его концентрация запишется 0,5 н.
Молярная концентрация и массовая доля
растворенного вещества связаны между собой. Предположим, что мы
знаем массовую долю растворенного вещества , плотность раствора и молярную массу растворенного вещества М. В качестве
вспомогательной величины возьмем объем раствора V. Тогда масса
раствора :
масса
растворенного вешества:
количество растворенного
вещества:
Подставляем выражение для количества
растворенного вещества в формулу для концентрации и сокращаем
объем раствора V:
Если из полученного соотношения
выразить массовую долю растворенного вещества, то:
Оба выражения (для концентрации и массовой доли) содержат
размерные величины, поэтому подстановка числовых значений
требует от них определенных размерностей: С[моль/л], М[г/моль],
[г/л]. Для перевода плотности из
размерности [г/мл] необходимо числовое значение умножить на
1000:
[г/л] = [г/мл]•1000
В чём разница между EC- и TDS-метрами?
Оба эти прибора измеряют один и тот же физический показатель — электропроводность раствора, т. е. его способность проводить электрический ток, по которой можно судить о концентрации солей в растворе. Разница между ними в том, что они измеряют этот показатель в разных единицах:
• EC-метр (EC, англ. electrical conductivity) измеряет электропроводность в стандартных единицах — mS/cm (миллисименс на сантиметр);
• TDS-метр (англ. Total dissolved solids, «общее количество растворённых частиц») вначале измеряет электропроводность, а затем конвертирует его в другую единицу измерения — ppm (англ. parts per million, «частей на миллион»). К примеру, 200 ppm означает, что в данном растворе на миллион частиц воды приходится 200 частиц некоего вещества, способного проводить ток.
Обратите внимание на слово «некоего». Штука в том, что TDS-метр и в самом деле не имеет ни малейшего понятия о химическом составе веществ, находящихся в растворе! Он показывает лишь число частиц электропроводящего вещества, но не знает, что это за вещество
Поэтому контроль состава веществ, находящихся в растворе, — задача самого выращивателя.
Формула молярной концентрации, единица измерения
Если в 1 литре раствора содержится известное количество молей одного из компонентов, то всегда можно рассчитать молярность такого раствора. Молярность, или молярная концентрация, измеряется в мольдм3 или мольл. Также единицы измерения иногда обозначаются как М.
К примеру, для раствора серной кислоты, содержащего в одном литре 2 моль Н2SO4, молярная концентрация может быть обозначена как 2М Н2SO4.
В формуле СМ обозначена молярная концентрация вещества или молярность, n — количество вещества, V — объем всего раствора. Получаемая в результате расчетов величина измеряется в мольл.
Можно выразить молярную концентрацию через массу и объем. Зная, что n=mM, получаем нужную формулу:
С=mV*M
Используя формулу молярной концентрации, можно проводить различные расчеты.
Ценность исследования
Основные показатели, на которые врач обращает внимание при расшифровке общего анализа крови — это гемоглобин и эритроциты, СОЭ, лейкоциты и лейкоцитарная формула. Остальные скорее являются вспомогательными
Чаще всего общий анализ крови назначают, чтобы понять, есть ли в организме воспаление и признаки инфекции, и если да, то какого происхождения — вирусного, бактериального или другого.
Также общий анализ крови может помочь установить анемию — малокровие. И если в крови есть ее признаки — назначают дополнительные анализы, чтобы установить причины.
Еще общий анализ крови назначают, если есть подозрение на онкологический процесс, когда есть ряд настораживающих симптомов и нужны зацепки. В этом случае кровь может косвенно подсказать, в каком направлении двигаться дальше.
Другие показания обычно встречаются реже.
1.1.1 Количество вещества — моль вещества
Каждый химический элемент отличается от других не только химическим символом (качественная характеристика), но некоторыми количественными параметрами. К ним относятся, прежде всего, атомная масса элемента и заряд его ядра (или порядковый номер элемента). Эти характеристики для каждого атома элемента приведена в Периодической системе элементов Д. И. Менделеева. Однако следует отметить, что приведенные массы атомов являются относительными величинами (так называемыми, атомными единицами массы или а.е.м.). Молекулярная массахимического соединения также легко определима, так как она равна сумме атомных масс составляющих данную молекулу атомов.
Однако количественные расчеты на практике необходимо проводить в привычных единицах массы (граммы, килограммы и т.д.), поэтому основная трудность, с которой сталкиваются при изучении химии — переход от относительных атомных и молекулярных масс химических веществ к единицам массы.
Переход к более привычным единицам массы (в граммах, например) легко осуществим, если использовать для этого одно из основных понятий химии — моль вещества.
Моль вещества — это количество вещества, содержащее 6,02·1023 атомов или молекул этого вещества.
Количественно масса 1 моль вещества — масса вещества в граммах, численно равная его атомной или молекулярной массе.
Пример: молекулярная масса воды H2O равна 18 а.е.м. (атомная масса водорода — 1, кислорода — 16, итого 1+1+16=18). Значит, один моль воды равен по массе 18 граммов, и эта масса воды содержит 6,02·1023 молекул воды.
Аналогично, масса 1 моля серной кислоты H2SO4 равна 98 граммов (1+1+32+16+16+16+16=98), а масса одной молекулы H2SO4 равна: 98г/6,02·1023 = 16,28·10-23 г.
Число 6,02·1023 называется числом Авогадро и является важнейшей мировой константой (NA = 6,02·1023 моль-1).
Таким образом, любое химическое соединение характеризуется массой одного моля или мольной (молярной) массой М, выражаемой в г/моль. Значит, М(H2O) = 18 г/моль, а М(H2SO4) = 98 г/моль.
Связь между количеством n (в молях) и массой m (в граммах) вещества выражается формулой:
| m = nM | (1.1) |
Возникает закономерный вопрос о необходимости введения термина «мольная масса вещества» и его применения, ведь для измерения массы вещества уже имеются величины, входящие в систему СИ: килограмм, грамм, тонна и т.д. Вопрос отпадает, если рассмотреть применение данных величин при анализе химических уравнений.
В общем случае уравнение химической реакции записывают в виде
,
где: A, B, C, D — вещества; a, b, c, d — коэффициенты уравнения.
Принято в левой части уравнения записывать исходные (реагирующие) вещества, а в правой части — продукты химической реакции.
В качестве примера рассмотрим простое химическое взаимодействие:
2Н2 + О2 = 2Н2О.
Данная запись показывает, что при взаимодействии двух молекул газообразного водорода Н 2 и одной молекулы газообразного кислорода О2 образуется две молекулы воды.
Учитывая, что М(Н2) = 2 г/моль, М(О2) = 32 г/моль и М(Н2О) = 18 г/моль, и сохраняя соотношения между числом молекул реагирующих веществ и продуктов реакции , имеем следующую картину:
| 2Н2 | + | О2 | = | 2Н2О |
| 2 молекулы | 1 молекулы | 2 молекулы | ||
| 200 молекул | 100 молекул | 200 молекул | ||
| 2·6,02·1023 молекул | 1·6,02·1023 молекул | 2·6,02·1023 молекул | ||
| 2 моль | 1 моль | 2 моль | ||
| 2·2 = 4 грамма | 1·32 = 32 грамма | 2·18 = 36 граммов |
Из данного примера видно, что количество моль реагирующих и образующихся в результате химической реакции веществ прямопропорционально коэффициентам в уравнении химической реакции.
Это позволяет проводить количественные расчеты, используя уравнения заданных химических реакций.
Пример: определить массуобразующейся воды при сжигании 16 граммов водорода в избытке кислорода.
Решение.
Используем уже знакомое нам уравнение реакции и расставим в нем требуемые величины.
Качественное описание
 Эти стекла, содержащие красный краситель, демонстрируют качественные изменения концентрации. Растворы слева более разбавленные по сравнению с более концентрированными растворами справа.
Эти стекла, содержащие красный краситель, демонстрируют качественные изменения концентрации. Растворы слева более разбавленные по сравнению с более концентрированными растворами справа.
Часто на неформальном, нетехническом языке, концентрация описывается качественным образом с использованием таких прилагательных, как «разбавленный» для растворов относительно низкой концентрации и «концентрированный» для растворов относительно высокой концентрации. Чтобы сконцентрировать раствор, нужно добавить больше растворенного вещества (например, спирта) или уменьшить количество растворителя (например, воды). Напротив, чтобы разбавить раствор, нужно добавить больше растворителя или уменьшить количество растворенного вещества. Если два вещества не смешиваются , существует концентрация, при которой растворенное вещество не растворяется в растворе. В этот момент говорят, что раствор насыщен . Если к насыщенному раствору добавить дополнительное растворенное вещество, оно не будет растворяться, за исключением определенных обстоятельств, когда может произойти перенасыщение . Вместо этого произойдет , что приведет к сосуществованию фаз, полностью разделенных или смешанных в виде суспензии . Точка насыщения зависит от многих переменных, таких как температура окружающей среды и точная химическая природа растворителя и растворенного вещества.
Концентрации часто называют уровни , отражающие ментальную схему из уровней на вертикальной оси в виде графика , который может быть высокой или низкой (например, «высокие сывороточные уровни билирубина» являются концентрации билирубина в сыворотке крови , которые больше , ).
Расшифровка
А теперь пройдемся по каждому из этих показателей и разберем, что они значат.
HGB — hemoglobin — Гемоглобин
Гемоглобин — это белок, который переносит по организму кислород и доставляет его в нужные ткани. Если его не хватает — клетки начинают голодать и развивается целая цепочка симптомов: слабость, утомляемость, головокружение, выпадение волос и ломкость ногтей, заеды в уголках губ и другие. Это симптомы анемии.
В молекулу гемоглобина входит железо, а еще в его формировании большую роль играют витамин В12 и фолиевая кислота. Если их не хватает — в организме нарушается синтез гемоглобина и развивается анемия.
Есть еще наследственные формы анемии, но они случаются гораздо реже и заслуживают отдельного разбора.
В норме гемоглобин составляет 120−160 г/л для женщин и 130-170 г/л для мужчин. Нужно понимать, что в каждом конкретном случае нормы зависят от лаборатирии. Поэтому смотреть нужно на референсные значения той лаборатории, в которой вы сдавали анализ.
Повышенные цифры гемоглобина чаще всего случаются из-за сгущения крови, если человек излишне потеет во время жары, или принимает мочегонные. Еще повышенным гемоглобин может быть у скалолазов и людей, которые часто бывают в горах — это компенсаторная реакция на недостаток кислорода. Еще гемоглобин может повышаться из-за заболеваний дыхательной системы — когда легкие плохо работают и организму все время не хватает кислорода. В каждом конкретном случае нужно разбираться отдельно.
Снижение гемоглобина — признак анемии. Следующим шагом нужно разбираться какой.
RBC — red blood cells — Эритроциты
Эритроциты — это красные клетки крови, которые транспортируют гемоглобин и отвечают за обменные процессы тканей и органов. Именно гемоглобин, а точнее — его железо, красит эти клетки в красный.
Нормы для мужчин — 4,2-5,6*10*9/литр. Для женщин — 4-5*10*9/литр. Которые опять-таки зависят от лаборатории.
Повышаться эритроциты могут из-за потери жидкости с потом, рвотой, поносом, когда сгущается кровь. Еще есть заболевание под названием эритремия — редкое заболевание костного мозга, когда вырабатывается слишком много эритроцитов.
Снижении показателей обычно является признаком анемии, чаще железодефицитной, реже — другой.
MCV— mean corpuscular volume — Средний объем эритроцитов
Норма — 80-95 для мужчин и 80-100 для женщин.
Объем эритроцитов уменьшается при железодефицитной анемии. А повышается — при В12 дефицитной, при гепатитах, снижении функции щитовидной железы.
HTC — hematocrit — Гематокрит
Это процентное соотношение форменных элементов крови к ее общему объему. Показатель помогает врачу дифференцировать, с чем связана анемия: потерей эритроцитов, что говорит о заболевании, или с избыточным разжижением крови.
PLT – platelets — тромбоциты
Это элементы крови, ответственные за формирование тромботического сгустка при кровотечениях. Превышение нормальных значений может свидетельствовать о физическом перенапряжении, анемии, воспалительных процессах, а может говорить о более серьезных проблемах в организме, среди которых онкологические заболевания и болезни крови.
Снижение уровня тромбоцитов в последние годы часто свидетельствует о постоянном приеме антиагрегантов (например, ацетилсалициловой кислоты) с целью профилактики инфаркта миокарда и ишемического инсульта головного мозга.
А значительное их снижение может быть признаком гематологических заболеваний крови, вплоть до лейкозов. У молодых людей — признаками тромбоцитопенической пурпуры и других заболеваний крови. Так же может появляться на фоне приема противоопухолевых и цитостатических препаратов, гипофункции щитовидной железы.
WВС — white blood cells – лейкоциты
Это основные защитники нашего организма, представители клеточного звена иммунитета. Повышение общего количества лейкоцитов чаще всего свидетельствует о наличии воспалительного процесса, преимущественно бактериальной природы. Также может оказаться признаком так называемого физиологического лейкоцитоза (под воздействием боли, холода, физической нагрузки, стресса, во время менструации, загара).
Нормы у мужчин и женщин обычно колеблются от 4,5 до 11,0*10*9/литр.
Снижение лейкоцитов – признак подавления иммунитета. Причиной чаще всего являются перенесенные вирусные инфекции, прием некоторых лекарств (в том числе нестероидных противовоспалительных и сульфаниламидов), похудение. Гораздо реже — иммунодефициты и лейкозы.
Eau (eu) de parfum: что это такое значит
Это парфюмированная вода, которая также считается одним из самых популярных и востребованных продуктов. Стоит она несколько дороже, чем предыдущая, но и устойчивость ее дольше – в среднем, 5 часов. Большое количество покупателей отдают предпочтение именно такому продукту, так как это идеальное соотношение цены и качества. Современные производители предлагают нам огромный выбор подобных изделий. Многие виды очень схожи с настоящими дорогими брендами. В качестве примера часто приводится парфюм Coco Chanel №5 – вы заплатите одинаковую сумму за маленький флакон 7,5 мл и парфюмированную жидкость с таким же благоуханием и объемом в 100 миллилитров.
Концентрация парфюмерной воды Eau de Parfum (EDP) означает, что в ней наличествуют 10-12% аромавеществ и до 90% спирта.
Eau de toilette
Сегодня EDT – один из самых популярных типов изделий. Покупателей больше всего привлекает относительно низкая цена. Нужно отметить, что это нестойкая продукция. Как правило, держится она в пределах трех часов. Ответ на вопрос: «Что это такое – Eau de toilette (EDT) в парфюмерии» дает его концентрация – она составляет не более 10%. Ей и определяется небольшая стойкость. Подобной водичкой можно душиться не один раз за сутки. Купив маленькую бутылочку и положив ее в сумочку, вы сможете пользоваться ею по мере необходимости. Благодаря своей ненасыщенности и легкости хорошо подходит даже в знойные летние дни.
Покупая данный вид парфюмерии, немногие из нас задумываются о его происхождении. А корни уходят далеко в античную Грецию и Египет, когда душистым раствором пользовались, чтобы наполнить помещение приятным благоуханием. Однако официальной версией создания данного продукта считается случай, когда Наполеона Бонапарта отправили в ссылку на остров St. Helena. Во время заточения у полководца Франции закончился одеколон. Тогда бывший император создал свою ароматную жидкость, главным компонентом которой был бергамот.
Почему EC практичнее, чем TDS/ppm?
EC практичнее потому, что это стандартизированный физический показатель, который во всём мире понимается одинаково. Именно поэтому, получив рекомендацию довести ваш раствор до EC 1,2, вы чётко понимаете, что имеется в виду показатель 1,2 mS/cm (миллисименс на сантиметр).
А вот при использовании TDS-метра не всё так однозначно, поскольку данный прибор использует другую единицу измерения — ppm (англ. parts per million, «долей на миллион»). И, в зависимости от того, где и для кого данный прибор был изготовлен, для конвертации из EC в ppm он может использовать один из трёх стандартов:
- Американский стандарт, продвигаемый производителями измерительного оборудования Hanna Instruments и Milwaukee, для конвертации из EC в TDS в качестве эталона использует раствор поваренной соли (NaCl). Cогласно этому стандарту:
1 EC = 500 ppm
- Европейский стандарт, продвигаемый фирмой-производителем Eutech, для конвертации из EC в TDS в качестве эталона использует раствор хлорида калия (KCl). Согласно этому стандарту:
1 EC = 640 ppm
- Австралийский стандарт, продвигаемый новозеладской фирмой-производителем Bluelab, для конвертации из EC в TDS в качестве эталона использует среднюю электрокондуктивность раствора трёх солей, присутствующих в питьевой воде (сульфат натрия, бикарбонат натрия, хлорид натрия), взятых в пропорции 40/40/20. Поэтому согласно этому стандарту:
1 EC = 700 ppm
Итак, если вы измеряете в EC, то полученные значения будут понятны кому угодно без дополнительных уточнений. А если вы пользуетесь TDS, то, читая прикладную литературу или обмениваясь на форуме данными, полученными с помощью TDS-метра, вам придётся каждый раз уточнять, о каком из трёх стандартов ppm идёт речь, что непродуктивно и утомительно.
Массовая доля в химии — что это за параметр
Другими словами, массовая доля части в целом расценивается как ее отношение к сумме масс всех, составляющих эту смесь, компонентов.
Для обозначения данного параметра введен символ ω (омега). ω может иметь процентное выражение либо измерятся в долях единицы.
Любая смесь (жидкая, твердая, газообразная) состоит из компонентов, сумма масс которых равна массе смеси. Их количество в единице объема конечного вещества различно. При приготовлении составов используются установленные рецептуры с соотношением компонентов. В смесях природного происхождения состав зависит от условий внешней среды.
Например, атмосферный воздух населенного пункта, имеющего производственный комбинат, будет различным по составу над жилой зоной и в радиусе выбросов в атмосферу производственных газов. Каждый из этих газов составляет в выбросах определенный процент. Зная его, а также общую массу выбросов, можно определить массу каждого компонента воздушной смеси и сравнить ее с аналогичными параметрами воздушных масс над жилой зоной.
На таком же принципе основаны экологические исследования состава вод открытых водоемов, сплавов, концентратов в пищевой промышленности, фармацевтических препаратов и т.д.
Понятие «массовая доля» хоть и является аналогичным понятиям «объемная доля» или «молярность», но отлично тем, что при ее определении используются именно массы компонентов и смеси в целом.
Умение определять массовую долю важно, например, если нужно рассчитать, сколько бензина можно получить из нефти определенной массы или какое количество каждого компонента взять для приготовления синтетических материалов. От массовых долей компонентов раствора зависит его плотность, что очень важно в химическом производстве
Плотность вещества рассчитывают на основании формулы:
От массовых долей компонентов раствора зависит его плотность, что очень важно в химическом производстве. Плотность вещества рассчитывают на основании формулы:. m вещества = ρ вещества × V вещества
m вещества = ρ вещества × V вещества
Исходя из этой формулы, если плотность воды 1 г/мл, то 1 мл воды будет иметь массу 1 г.